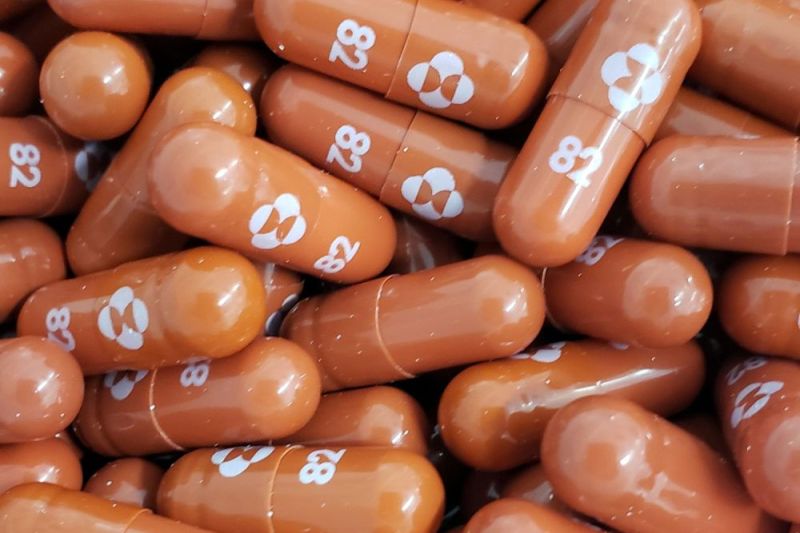
Uji coba klinis fase ke-3 melibatkan 775 orang pasien COVID-19 dengan gejala ringan dan sedang selama lima hari atau kurang. Mereka ini mempunyai setidaknya satu faktor risiko seperti obesitas, diabetes mellitus, penyakit jantung dan juga usia tua lansia atau di atas 60 tahun.
Hasilnya menunjukkan, sekitar 7 persen partisipan studi yang menerima obat ini kemudian dirawat di rumah sakit dan tidak ada satupun yang meninggal. Sementara pada kelompok yang mendapat plasebo, sebanyak 14 persen dirawat di rumah sakit atau meninggal.
Guru Besar Fakultas Kedokteran Universitas Indonesia, Prof. Tjandra Yoga Aditama mengatakan, uji klinis pada pasien yang dirawat di rumah sakit sempat dihentikan, karena tidak menunjukkan hasil yang baik pada pasien yang sudah masuk rumah sakit.
"Waktu bulan April itu diputuskan penelitian diteruskan hanya pada mereka yang belum masuk rumah sakit, yang hasilnya baru diumumkan 1 Oktober ini," kata dia yang pernah menjabat sebagai Direktur WHO Asia Tenggara dan Dirjen P2P & Ka Balitbangkes itu.
Berbicara kemanjuran, Tjandra menuturkan, hasil penelitian pada 40 persen sampelnya menunjukkan efikasi molnupiravir konsisten pada berbagai varian yang ditemukan, yaitu Gamma, Delta, dan Mu.
Kendati begitu, kemanjuran obat dikatakan 50 persen lebih rendah daripada antibodi monoklonal yang digunakan untuk mengobati orang berisiko tinggi terkena COVID-19 bergejala ringan atau sedang. Penelitian menunjukkan, antibodi tersebut mengurangi rawat inap dan kematian hingga 85 persen di antara pasien tersebut.
Tetapi para ahli, seperti dikutip dari The New York Times, mengatakan pil antivirus baru kemungkinan besar akan berdampak lebih besar pada COVID-19 daripada antibodi yang rumit, karena pil dapat menjangkau lebih banyak orang.
Sebelumnya, Organisasi Kesehatan Dunia (WHO) melalui pedoman terbaru “WHO Therapeutics and COVID-19: living guideline” yang diterbitkan pada 24 September 2021 memberikan rekomendasi pada beberapa obat kombinasi antibodi monoklonal netralisasi yaitu casirivimab dan imdevimab, penghambat reseptor interleukin 6 (IL-6 receptor blockers) yaitu tocilizumab atau sarilumab dan kortikosteroid.
Dari sisi cara kerja, pil dirancang untuk memblokir virus agar tidak bereplikasi. Molnupiravir menipu virus corona agar menggunakan obat untuk mencoba mereplikasi materi genetik virus. Setelah proses itu berlangsung, obat akan memasukkan kesalahan ke dalam kode genetik.
"Jika Anda membuat cukup banyak kesalahan atau Anda membuat kesalahan di bagian yang benar-benar kritis, virus tidak dapat mereplikasi," ujar wakil presiden penelitian vaksin dan penyakit menular di Merck, Daria Hazuda.
Pil perlu diminum sesegera mungkin setelah seseorang menunjukkan gejala COVID-19 yakni saat virus bereplikasi dengan cepat dan sistem kekebalan belum memasang pertahanan. Dalam uji coba, sukarelawan harus menunjukkan gejala dalam lima hari terakhir.
Sementara itu terkait efek samping, studi memperlihatkan tidak ada yang serius di antara para sukarelawan dalam uji klinis Molnupiravir. Peneliti mencatat efek samping umumnya ringan seperti sakit kepala dan ini sulit dibedakan apakah akibat COVID-19 atau bukan.
Siapa yang akan dapatkan pil ini?
Berbekal hasil uji klinik fase 3, pihak Merck berencana mencari otorisasi darurat dari BPOM Amerika Serikat (FDA) untuk bisa digunakan warga Amerika sesegara mungkin. Bila semua proses berjalan lancar, regulator bisa mengesahkan obat tersebut sebelum akhir tahun ini.
Kepala penasihat medis untuk Presiden Amerika Serikat, Dr. Anthony S. Fauci, mengatakan tidak dapat memberikan batas waktu tertentu untuk persetujuan.
"FDA akan melihat data dan dengan cara yang sangat efisien dan efektif akan memeriksa data secepat mungkin," tutur dia.
Bila disetujui, maka pil hanya ditujukan untuk pasien COVID-19 yang tidak dirawat rumah sakit. Uji klinis fase 3 hanya melibatkan mereka yang belum divaksinas karena dianggap berisiko tinggi terkena COVID-19 seperti halnya lansia atau orang dengan kondisi medis seperti diabetes atau penyakit jantung.
Walau begitu, para pakar berharap nantinya obat pada akhirnya akan tersedia untuk kalangan masyarakat lebih luas.
Merck berharap bisa memproduksi pil untuk 10 juta orang pada akhir tahun 2021. Pemerintah Amerika Serikat bahkan sudah memesan sebanyak 1,7 program pengobatan yang sebenarnya tak cukup untuk semua orang warganya yang terkena COVID-19.
Biaya yang dikeluarkan sekitar 700 dolar Amerika per perawatan atau setara Rp 9,9 juta. Jumlah ini sekitar sepertiga dari biaya pengobatan antibodi monoklonal. Rencananya, obat tersedia gratis untuk orang Amerika seperti halnya vaksin COVID-19.
Sementara itu, Pfizer, Atea Pharmaceuticals dan Roche juga sedang mengembangkan pil serupa. Hasil dari uji klinis mereka diharapkan bisa dirilis dalam beberapa bulan ke depan.
Baca juga: Merck klaim molnupiravir kurangi risiko kematian akibat COVID-19
Baca juga: Misinformasi! Molnupiravir segera beredar untuk sembuhkan COVID-19
Pewarta: Lia Wanadriani Santosa
Editor: Alviansyah Pasaribu
Copyright © ANTARA 2021